Thuốc Tagrisso 40mg, Hộp 30 Viên
* Hình sản phẩm có thể thay đổi theo thời gian
** Giá sản phẩm có thể thay đổi tuỳ thời điểm
30 ngày trả hàng Xem thêm

Lưu ý: Sản phẩm này chỉ bán khi có chỉ định của bác sĩ, mọi thông tin trên Website chỉ mang tính chất tham khảo.
.svg)
Bạn muốn nhận hàng trước 4h hôm nay. Đặt hàng trong 55p tới và chọn giao hàng 2H ở bước thanh toán. Xem chi tiết
Chỉ dành cho mục đích thông tin. Tham khảo ý kiến bác sĩ trước khi dùng bất kỳ loại thuốc nào.
Thông tin sản phẩm
Nội dung sản phẩm
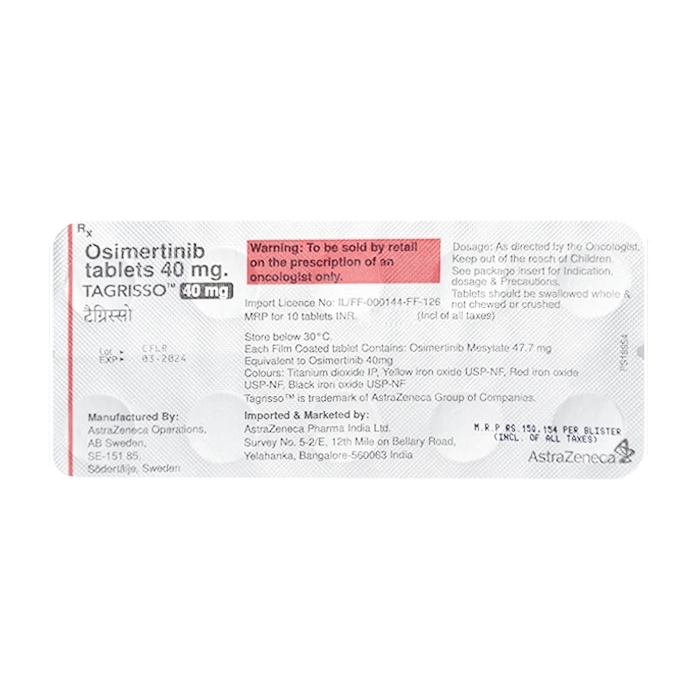
Thành phần
- Osimertinib: 40mg.
Công dụng (Chỉ định)
Thuốc Tagrisso (Osimertinib) được chỉ định trong các trường hợp:
- Điều trị bước 1 ở bệnh nhân trưởng thành ung thư phổi loại không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn có đột biến hoạt hóa thụ thể yếu tố phát triển biểu bì (EGFR).
- Điều trị bệnh nhân trưởng thành ung thư phổi loại không tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn có đột biến EGFR T790M dương tính.
Liều dùng - Cách dùng
- Liều khuyến cáo là 80 mg osimertinib, 1 lần/ngày cho đến khi bệnh tiến triển trở lại hoặc xuất hiện độc tính phản ứng ngoại ý không thể chấp nhận.
- Nếu quên 1 liều Tagrisso, nên uống thuốc ngay trừ phi liều kế tiếp sẽ được dùng trong vòng 12 giờ.
- Tagrisso có thể uống kèm hoặc không kèm thức ăn tại cùng một thời điểm mỗi ngày.
Điều chỉnh liều:
- Có thể cần ngưng liều và/hoặc điều chỉnh liều dựa trên mức độ an toàn và dung nạp của mỗi cá nhân. Nếu cần giảm liều, nên giảm xuống liều 40 mg, 1 lần/ngày.
Các nhóm bệnh nhân đặc biệt:
- Không cần chỉnh liều do tuổi, cân nặng, giới tính, chủng tộc hoặc tình trạng hút thuốc của bệnh nhân (xem phần Đặc tính dược động học).
Bệnh nhân suy gan:
- Dựa trên các nghiên cứu lâm sàng, không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ (Child Pugh A) hoặc suy gan trung bình (Child Pugh B). Tương tự, dựa vào phân tích trên dân số đánh giá dược động học, không cần điều chỉnh liều ở bệnh nhân suy gan nhẹ (tổng bilirubin ≤ giới hạn trên của mức bình thường (ULN) và men aspartate aminotransferase (AST) >ULN hoặc tổng bilirubin >1,0 đến 1,5x ULN và xuất hiện AST) hoặc ở bệnh nhân suy gan trung bình (tổng bilirubin từ 1,5 đến 3 lần ULN và có xuất hiện AST). Hiệu quả và tính an toàn của thuốc chưa được thiết lập trên bệnh nhân suy gan nặng. Cho đến khi có dữ liệu mới, không khuyến cáo dùng trên bệnh nhân suy gan nặng (xem phần Đặc tính dược động học).
Bệnh nhân suy thận:
- Dựa vào các nghiên cứu lâm sàng và phân tích trên dân số đánh giá dược động học, không cần chỉnh liều ở bệnh nhân suy thận nhẹ, trung bình hoặc nặng. Tính an toàn và hiệu quả của thuốc chưa được thiết lập ở bệnh nhân bệnh thận giai đoạn cuối [độ thanh thải creatinin (CLcr) thấp hơn 15 mL/phút được tính theo công thức Cockcroft and Gault] hoặc đang lọc máu. Nên thận trọng khi điều trị cho bệnh nhân suy thận nặng và bệnh thận giai đoạn cuối (xem phần Đặc tính dược động học).
Quá liều
- Trong các nghiên cứu lâm sàng đã có một số ít bệnh nhân dùng Tagrisso liều hàng ngày lên đến 240 mg mà không ghi nhận độc tính giới hạn liều (dose limiting toxicities). Trên các nghiên cứu này, bệnh nhân dùng Tagrisso với liều hàng ngày 160 mg và 240 mg đã ghi nhận có sự tăng tần suất và mức độ trầm trọng các phản ứng ngoại ý điển hình gây ra do EGFR TKI (chủ yếu là tiêu chảy và nổi mẩn da) so với mức liều 80 mg. Rất ít kinh nghiệm về quá liều ngẫu nhiên trên người. Tất cả các trường hợp đều xảy ra riêng lẻ là do bệnh nhân sai sót khi dùng thuốc mà không gặp bất kỳ hậu quả lâm sàng nào.
- Không có xử trí đặc biệt trong trường hợp quá liều Tagrisso. Khi nghi ngờ quá liều, nên ngưng dùng Tagrisso và bắt đầu xử trí triệu chứng.
Không sử dụng trong trường hợp sau (Chống chỉ định)
- Quá mẫn với hoạt chất hoặc bất kỳ tá dược nào.
Tác dụng không mong muốn (Tác dụng phụ)
Các phản ứng ngoại ý do thuốc được liệt kê theo nhóm hệ cơ quan (SOC) trong MedDRA. Trên mỗi nhóm hệ cơ quan, các phản ứng ngoại ý được xếp hạng dựa theo tần suất xảy ra với các phản ứng xảy ra thường xuyên nhất được liệt kê đầu tiên. Trong mỗi nhóm tần suất, phản ứng ngoại ý được liệt kê theo mức nghiêm trọng giảm dần. Ngoài ra, phân loại tần suất tương ứng cho mỗi ADR được dựa trên quy ước CIOMS III và định nghĩa như sau: rất thường gặp (≥1/10); thường gặp (≥1/100 - <1/10); không thường gặp (≥1/1.000 - <1/100); hiếm gặp (≥1/10.000 - <1/1.000); rất hiếm (<1/10.000); chưa rõ (không thể dự đoán từ dữ liệu sẵn có).
- Các phát hiện về tính an toàn trong các nghiên cứu một nhánh pha 2 AURAex và AURA2 nhìn chung đồng nhất với những quan sát trên nhánh dùng Tagrisso của nghiên cứu AURA3. Không ghi nhận có độc tính khác hoặc bất ngờ và các biến cố ngoại ý là tương tự về loại, mức độ nghiêm trọng và tần số.
Tương tác với các thuốc khác
Các thuốc cảm ứng CYP3A4 mạnh có thể làm giảm nồng độ và thời gian tiếp xúc của osimertinib. Osimertinib có thể làm tăng nồng độ và thời gian tiếp xúc của chất nền protein kháng ung thư vú (BCRP) và P-glycoprotein (P-gp).
Hoạt chất có thể làm tăng nồng độ osimertinib trong huyết tương:
- Các nghiên cứu in vitro đã cho thấy osimertinib được chuyển hóa pha I chủ yếu qua CYP3A4 và CYP3A5. Trong một nghiên cứu dược động học trên lâm sàng, khi dùng chung với 200 mg itraconazole (chất ức chế CYP3A4 mạnh) x 2 lần/ngày đã không ảnh hưởng đáng kể về lâm sàng trên nồng độ và thời gian tiếp xúc với osimertinib (diện tích dưới đường cong (AUC) tăng 24% và Cmax giảm 20%). Vì vậy, chất ức chế CYP3A4 có lẽ không ảnh hưởng đến nồng độ và thời gian tiếp xúc của osimertinib. Chưa xác định được các men xúc tác thêm.
Hoạt chất có thể làm giảm nồng độ osimertinib trong huyết tương:
- Trong một nghiên cứu dược động học lâm sàng trên bệnh nhân, diện tích nồng độ osimertinib dưới đường cong ở giai đoạn ổn định (AUC steady state) giảm 78% khi dùng chung với rifampicin (600mg/ngày trong 21 ngày). Tương tự, nồng độ và thời gian tiếp xúc với chất chuyển hóa AZ5104 cũng giảm 82% (đối với trị số AUC) và 78% (đối với trị số Cmax). Khuyến cáo nên tránh dùng Tagrisso đồng thời với các chất cảm ứng CYP3A mạnh (như phenytoin, rifampicin và carbamazepin). Các chất cảm ứng CYP3A4 trung bình (như bosentan, efavirenz, etravirine, modafinil) có thể cũng làm giảm nồng độ và thời gian tiếp xúc osimertinib và nên sử dụng thận trọng hoặc tránh dùng nếu có thể. Chưa có dữ liệu lâm sàng để khuyến cáo chỉnh liều Tagrisso. Chống chỉ định dùng chung với thuốc St. John's Wort (xem phần Chống chỉ định).
Ảnh hưởng của các thuốc làm giảm dịch dạ dày trên osimertinib:
- Trong một nghiên cứu dược động học lâm sàng, việc dùng đồng thời với omeprazole đã không thay đổi nồng độ và thời gian tiếp xúc của osimertinib trên lâm sàng. Các chất điều biến pH dịch vị có thể dùng chung với Tagrisso mà không có bất kỳ hạn chế nào.
- Hoạt chất có nồng độ trong huyết tương có thể thay đổi do Tagrisso
- Theo các nghiên cứu in vitro, osimertinib là chất ức chế cạnh tranh của chất vận chuyển BCRP.
- Trong một nghiên cứu dược động học trên lâm sàng, khi dùng đồng thời Tagrisso với rosuvastatin (chất nền nhạy cảm BCRP) sẽ làm tăng AUC và Cmax của rosuvastatin tương ứng là 35% và 72%. Ở bệnh nhân đang dùng đồng thời với các thuốc có khuynh hướng phụ thuộc BCRP và có chỉ số điều trị thấp, nên theo dõi chặt chẽ về dấu hiệu thay đổi tính dung nạp của thuốc dùng chung vì có thể là kết quả của sự tăng nồng độ và thời gian tiếp xúc trong khi dùng chung với Tagrisso (xem phần Đặc tính dược động học).
- Trong một nghiên cứu dược động học trên lâm sàng, việc dùng đồng thời Tagrisso với simvastatin (chất nền nhạy cảm CYP3A4) sẽ làm giảm AUC và Cmax của simvastatin tương ứng là 9% và 23%. Các thay đổi này nhỏ và có lẽ là không đáng kể về mặt lâm sàng. Không chắc xảy ra tương tác dược động học trên lâm sàng với chất nền CYP3A4. Không loại bỏ nguy cơ giảm nồng độ và thời gian tiếp xúc của hormon ngừa thai khi dùng đồng thời.
- Trong một nghiên cứu lâm sàng về tương tác thuốc của thụ thể Pregnane X (PXR), sử dụng đồng thời Tagrisso với fexofenadine (chất nền P-gp) đã làm tăng AUC và Cmax của fexofenadine tương ứng là 56% (90% CI 35, 79) và 76% (90% CI 49, 108) sau khi dùng một liều duy nhất, và 27% (90% CI 11, 46) và 25% (90% CI 6, 48) khi ở trạng thái ổn định. Bệnh nhân dùng đồng thời với các thuốc phụ thuộc P-gp và có ngưỡng trị liệu hẹp (như digoxin, dabigatran, aliskiren) nên được theo dõi chặt chẽ các dấu hiệu thay đổi khả năng dung nạp do tăng mức tiếp xúc của thuốc dùng đồng thời với Tagrisso
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Đánh giá tình trạng đột biến EGFR:
- Khi xem xét dùng Tagrisso để điều trị cho bệnh nhân ung thư phổi loại không phải tế bào nhỏ (NSCLC) giai đoạn tiến triển tại chỗ hoặc di căn, việc xác định tình trạng đột biến EGFR dương tính là rất quan trọng. Nên thực hiện một xét nghiệm đã được công nhận bằng cách sử dụng mẫu DNA khối u lấy từ mẫu mô hoặc mẫu DNA khối u trong hệ tuần hoàn (ctDNA) thu thập từ mẫu huyết tương.
- Chỉ dùng các phương pháp xét nghiệm có độ tái lập, độ tin cậy, độ nhạy cùng với tính ứng dụng (utility) đã được kiểm chứng để xác định tình trạng đột biến EGFR của mẫu DNA khối u (từ mẫu mô hoặc mẫu huyết tương).
- Việc xác định tình trạng dương tính của đột biến EGFR sử dụng xét nghiệm trên mẫu mô hoặc mẫu huyết tương sẽ cho biết có đủ điều kiện điều trị với Tagrisso. Tuy nhiên, nếu sử dụng xét nghiệm mẫu DNA khối u trong hệ tuần hoàn dựa trên mẫu huyết tương và có kết quả âm tính, khuyến cáo nên theo dõi tiếp bằng xét nghiệm từ mẫu mô nếu có thể vì có khả năng xét nghiệm mẫu huyết tương cho kết quả âm tính giả.
Bệnh phổi mô kẽ (ILD):
- Bệnh phổi mô kẽ (ILD) trầm trọng/đe dọa đến tính mạng/gây tử vong hoặc phản ứng ngoại ý giống ILD (như viêm phổi không do nhiễm trùng) đã được ghi nhận ở bệnh nhân dùng Tagrisso trong các nghiên cứu lâm sàng. Hầu hết các trường hợp được cải thiện hoặc biến mất khi ngưng điều trị. Bệnh nhân có tiền sử ILD trước đây, đã dùng thuốc gây ILD, viêm phổi do xạ trị mà yêu cầu dùng steroid hoặc có bất kỳ bằng chứng ILD tiến triển trên lâm sàng đã được loại trừ khỏi các nghiên cứu lâm sàng này (xem phần Tác dụng không mong muốn).
- Đã ghi nhận bệnh phổi mô kẽ (ILD) hoặc phản ứng ngoại ý giống ILD (như viêm phổi không do nhiễm trùng) ở 3,9% bệnh nhân và tử vong ở 0,4% trên tổng số 1142 bệnh nhân dùng Tagrisso trong các nghiên cứu FLAURA và AURA. Tần xuất xảy ra ILD là 10,4% ở bệnh nhân là người Nhật bản, 1,8% ở bệnh nhân Châu Á và 2,8% ở nhóm bệnh nhân không thuộc chủng tộc Châu Á (xem phần Tác dụng không mong muốn).
- Cần đánh giá thận trọng để loại trừ ILD đối với tất cả bệnh nhân khởi phát cấp tính triệu chứng đường hô hấp (khó thở, ho, sốt) và/hoặc các triệu chứng này trở nên nặng hơn không giải thích được. Nên ngưng điều trị bằng thuốc này trong khi đang kiểm tra các triệu chứng trên. Nếu đã chẩn đoán là ILD, nên ngưng Tagrisso và bắt đầu các liệu pháp điều trị cần thiết. Việc sử dụng lại Tagrisso chỉ nên được xem xét sau khi cân nhắc cẩn thận lợi ích và nguy cơ của từng bệnh nhân.
- Hội chứng Stevens-Johnson
- Các báo cáo ca lâm sàng của hội chứng Stevens-Johnson (SJS) hiếm khi được ghi nhận liên quan đến điều trị Tagrisso. Trước khi bắt đầu điều trị, bệnh nhân nên được thông báo về các dấu hiệu và triệu chứng của hội chứng SJS. Nếu xuất hiện các dấu hiệu và triệu chứng gợi ý về hội chứng SJS, nên ngưng tạm thời hoặc ngừng Tagrisso ngay lập tức.
Kéo dài khoảng QTc:
- Khoảng QTc kéo dài xuất hiện trên bệnh nhân dùng Tagrisso và có thể dẫn đến tăng nguy cơ nhịp nhanh thất (như xoắn đỉnh) hoặc tử vong đột ngột. Không có biến cố loạn nhịp nào được ghi nhận trong các nghiên cứu FLAURA hoặc AURA (xem phần Tác dụng không mong muốn). Bệnh nhân có bất thường về nhịp và dẫn truyền nặng trên lâm sàng khi đo điện tâm đồ lúc nghỉ (ECG) (như là khoảng QTc lớn hơn 470 mili giây) đã được loại trừ trong các nghiên cứu này (xem phần Tác dụng không mong muốn).
- Khi có thể, nên tránh dùng osimertinib trên bệnh nhân có hội chứng QT kéo dài bẩm sinh. Nên theo dõi định kỳ điện tâm đồ (ECGs) và chất điện giải trên bệnh nhân suy tim sung huyết, rối loạn điện giải hoặc ở bệnh nhân đang dùng thuốc đã biết làm kéo dài khoảng QTc. Nên ngưng điều trị ở bệnh nhân có khoảng QTc lớn hơn 500 mili giây được ghi nhận trên ít nhất 2 lần đo điện tâm đồ tách biệt cho đến khi khoảng QTc nhỏ hơn 481 mili giây hoặc phục hồi về trị số căn bản nếu khoảng QTc lớn hơn hoặc bằng 481 mili giây, sau đó có thể dùng lại Tagrisso ở mức liều giảm như trình bày tại Bảng 6. Nên ngưng osimertinib vĩnh viễn ở bệnh nhân có khoảng QTc kéo dài đi kèm với các biến cố sau: xoắn đỉnh, nhịp nhanh thất đa dạng, có dấu hiệu/triệu chứng loạn nhịp trầm trọng.
Thay đổi tính co thắt cơ tim:
- Trong các nghiên cứu lâm sàng, phân suất tống máu thất trái (Left Ventricular Ejection Fraction - LVEF) giảm ≥10% và một sự sụt giảm <50% đã xảy ra trong 3,9% (35/908) bệnh nhân dùng Tagrisso, là những người có đánh giá LVEF khi khởi đầu điều trị và tối thiểu 1 lần theo dõi sau đó. Trên bệnh nhân có các yếu tố nguy cơ trên tim và những người có các tình trạng có thể ảnh hưởng đến LVEF, nên xem xét theo dõi tim, bao gồm đánh giá LVEF khi khởi đầu (at baseline) và trong khi điều trị. Trên bệnh nhân có dấu hiệu/triệu chứng tim liên quan trong khi điều trị, việc theo dõi tim bao gồm đánh giá LVEF nên được xem xét.
Phụ nữ mang thai và cho con bú
- Chưa có báo cáo.
Người lái xe và vận hành máy móc
- Chưa có báo cáo.
Bảo quản
- Nơi mát, tránh ánh sáng, nhiệt độ dưới 30⁰C.
Đánh Giá - Bình Luận
-
Nhà Thuốc Minh Châu 354
354 Nguyễn Văn Công ( Phường 3, GV ) Phường Hạnh Thông, Tp HCM
-
Nhà Thuốc Minh Châu 522
285 Bạch Đằng ( Phường 3 GV ) Phường Hạnh Thông, Tp HCM
0918008095| 7:00 - 22:00
-
Nhà Thuốc 114 Bạch Đằng
D114 Bạch Đằng ( Phường 2, Tân Bình ) Phường Tân Sơn Hòa, Tp HCM
-
Nhà Thuốc Minh Châu 167
167 Phổ Quang ( Phường 9, Phú Nhuận ) Phường Đức Nhuận, Tp HCM
0939115175| 7:00 - 22H00
-
Nhà thuốc minh châu 540
54 Nguyễn Thương Hiền ( Phường 1, GV ) Phường Hạnh Thông, TP.HCM
0818002244| 7:30 - 22:00
-
Nhà Thuốc Minh Châu 690
( 261 Phạm Văn Chiêu, Phường 14, GV ) 69/10x Phạm Văn Chiêu, Phường An Hội Tây, TPHCM
0988115175| 7:00 - 22H00
-
Nhà thuốc minh châu 153
153 Lê Văn Chí ( Phường Linh Trung, Thủ Đức ) Phường Linh Xuân, TP.HCM
0975115175| 7:00 - 22:00
-
CSKH Online
354 Nguyễn Văn Công ( Phường 3, GV ) Phường Hạnh Thông, Tp HCM
0899791368| 08:00 - 17:00
-
CSKH Online
354 Nguyễn Văn Công ( Phường 3, GV ) Phường Hạnh Thông, Tp HCM
0899391368| 14:00 - 22:00
- Đặt đơn thuốc trong 30 phút. Gửi đơn
- Giao nhanh 2H nội thành HCM Chính sách giao hàng 2H.
- Đổi trả trong 6 ngày. Chính sách đổi trả